生物医药行业动态第三期
- 发布时间:2025-04-22 10:55:26
- 发布作者:admin
- 预览次数:221
时事政策
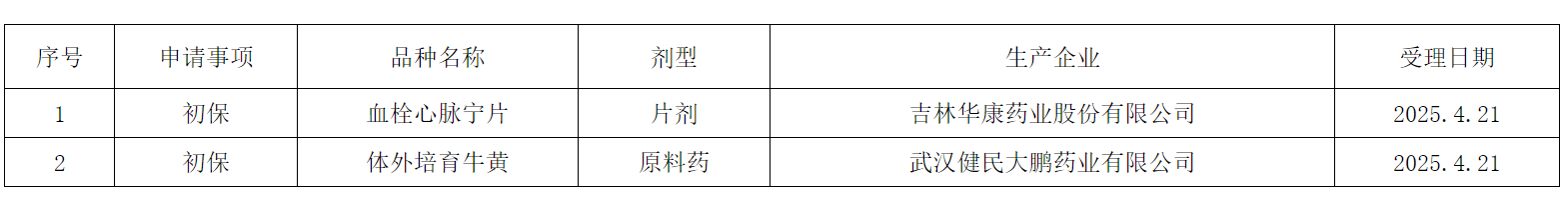
行业动态
湖北省药品MAH转化平台由长江产业投资集团、国药控股、九州通、湖北省药品MAH转化联盟、武汉国家生物产业基地建设服务中心于2023年11月联合发起成立,是全国第一家由国资和上市公司联合发起的省级MAH转化平台。平台旨在抓住MAH制度重塑医药产业格局的重大机遇,以“用”为导向,以“需”为牵引,整合湖北省及外延地区医药产业链资源,销售带动,创新引领,产能释放,资本赋能,推动“研-产-销-投”一体化,打造共创、共享、共赢的MAH转化平台,构建科技创新供应链,大力推进生物医药的高质量发展。

- 下一篇 > 生物医药行业动态第二期




 友情链接
友情链接
